Autoanticuerpos contra receptores muscarínicos en cáncer de
mama
Gabriel Fiszman1, Valentina Cattaneo1,
Eulalia de la Torre2, Lucas Colombo1, Cristina Middonno1,
Eugenia Sacerdote de Lustig1, María Elena Sales2*
1Instituto de
Oncología A.H. Roffo. Facultad de Medicina UBA. 2Centro de Estudios
Farmacológicos y Botánicos (CEFYBO-CONICET). Facultad de Medicina, UBA.
e-mail: mesales@2vias.com.ar
Recibido: 11/11/05
Aceptado: 6/12/05
Resumen
Se ha investigado exhaustivamente, la capacidad de células
transformadas para inducir una respuesta inmune eficaz en portadores de tumor.
En particular, la detección y el papel
de anticuerpos (Acs) específicos contra antígenos (Ags) tumorales en los
pacientes con cáncer ha dado resultados contrapuestos. Previamente
caracterizamos la expresión de receptores colinérgicos muscarínicos (RCM) en
células LM3, derivadas de un adenocarcinoma mamario murino espontáneo de la
cepa BALB/c. Estas células presentan una mayor expresión de RCM en comparación
con células normales de epitelio mamario murino, NMuMG. En este trabajo,
investigamos la capacidad de las proteínas RCM sobre-expresadas para inducir una respuesta humoral autóloga
en portadores del tumor LM3 y la función de los Acs
formados en la progresión tumoral. Detectamos autoAcs contra RCM en la fracción
IgG purificada del suero de portadores de tumor pequeño (Tp) y tumor grande (TG) formados 14 días y
28 días después de la inoculación subcutánea de células tumorales, respectivamente.
La IgG proveniente del suero de portadores de Tp estimula significativamente la
proliferación de células tumorales, mientras que la de portadores de TG la
inhibe. Ambos efectos fueron reducidos por el
pretratamiento de las células LM3 con el antagonista muscarínico
atropina (AT). La IgG purificada de animales normales estimuló la proliferación
de células LM3 pero el efecto no fue modificado por AT. La IgG de portadores de tumor desplazó la unión del
radioligando muscarínico tritiado, bencilato de quinuclidinilo ([3H]-QNB)
a los RCM en células LM3 en forma dependiente de la concentración, lo que
evidenció la interacción de los Acs con los receptores expresados en dichas
células. Asimismo, la IgG de portadores de tumor reconoció, en ensayos de inmunomarcación
de homogenatos de corazón murino, una proteína cuyo peso molecular coincide con
la que reconoce un Ac monoclonal específico contra el receptor muscarínico de
acetilcolina M2. Resultados análogos se obtuvieron en homogenatos de
tumor y lisados de células LM3. Además observamos que la IgG purificada de
portadores de TG estimula la respuesta neovascular inducida por células LM3 con
participación de los RCM. Concluimos que los
autoAcs presentes en el suero de portadores de tumor ejercen efectos protumorales
diferentes por vía muscarínica: mientras que en portadores de Tp estimulan la
proliferación de células LM3 en portadores de TG, promueven la
neovascularización.
Abstract
The presence and
the role of antibodies (Abs) directed against tumor antigens in cancer patients
has given off contradictory evidences. We had previously detected and
characterized muscarinic acetylcholine receptors (mAchR) in mammary tumor LM3
cells from BALB/c mice. These cells over-expressed mAchR from the M2
subtype, in comparison with normal mammary cells. Here we investigate the
ability of up regulated mAchR to induce a humoral autoimmune response in LM3
tumor bearers and autoAbs function in tumor progression. IgG fraction purified
from small (sT) (14 days LM3 tumor) stimulated tumor cells proliferation while
IgG from big tumor (bT) bearers (28 days LM3 tumor) inhibited tumor cells
growth. Both effects were reduced by atropine (AT). We also observed that IgG
from tumor bearers displaced the binding of the tritiated muscarinic antagonist
[3H]-QNB to LM3 cells in a
concentration dependent manner, and recognized by immunoblotting a 70 kDa
protein in tumor cells and murine heart membrane enriched fraction, that is
also recognized by a monoclonal antibody against M2 receptor,
revealing IgG interaction with mAchR. In addition IgG from bT bearing mice
potentated neovascular response induced in vivo by LM3 cells, effect that was
reduced by AT. In conclusion autoAbs against mAchR from LM3 tumor bearing mice
exert different pro-tumor actions depending on the stage of tumor development:
in sT bearing mice they stimulate tumor cells proliferation while in bT animals
they potentate tumor neovascularization.
Introducción
Los conceptos sobre
el papel del sistema inmune en la protección contra el cáncer se han enmarcado
en dos posiciones extremas. Según la teoría de la inmunovigilancia, las células
inmunocompetentes son las encargadas de detectar y eliminar células tumorales y
desempeñan la función más importante para controlar el crecimiento tumoral. En
oposición, la hipótesis de la estimulación inmune predice que bajos niveles de
activación del sistema inmune producen una respuesta que potencia el
crecimiento tumoral (1). En tumores
humanos, se ha demostrado la presencia de un infiltrado de células
inflamatorias, con predominio de linfocitos y macrófagos, aunque también pueden
encontrarse células dendríticas, granulocitos
y mastocitos. Se ha comprobado que estas células se encuentran activadas
pues expresan receptores de interleuquina-2 o productos de clase II del
complejo mayor de histocompatibilidad. Sin embargo no se le ha podido asignar a
la presencia de células inmunocompetentes un valor pronóstico en relación con
la progresión del tumor (2). Durante la
década del ´80, los inmunólogos sugirieron que los linfocitos B de pacientes
con neoplasias eran incapaces de desarrollar una respuesta inmune contra el
tumor. Más aún, afirmaban que los Acs producidos por estas células no desempeñaban
ningún papel en la progresión tumoral (3). Sin embargo recientemente se han
detectado anticuerpos (Acs) en el suero de pacientes oncológicos que reconocen
proteínas propias sobreexpresadas como las del golpe de calor, neuronales y
nucleares (4-6). En mujeres con cáncer de mama se identificaron autoAcs con
diferentes especificidades y se sabe que las células B que infiltran los
carcinomas medulares de mama producen Acs contra autoantígenos (autoAgs) de
membrana expuestos durante la apoptosis de células tumorales (7). Previamente
hemos informado que las células LM3, derivadas del adenocarcinoma mamario
murino M3, expresan constitutivamente altas concentraciones de receptores
colinérigicos muscarínicos (RCM) en comparación con células de epitelio mamario
murino normal, NMuMG (8). Por ensayos de inmunomarcación con Acs específicos
contra todos los subtipos de receptores colinérigicos muscarínicos (M1-M5)
demostramos una expresión mayoritaria del subtipo M2 en las células
LM3. En este trabajo nos proponemos investigar la presencia de Acs contra
dichos RCM en el suero de portadores de tumor pequeño (Tp) y tumor grande (TG)
(14 y 28 días de portación del tumor LM3, respectivamente). Asimismo estudiamos
la capacidad de estos Acs para modular la proliferación celular y la
angiogénesis tumoral.
Materiales y Métodos
Cultivos
de líneas celulares
Se
utilizaron células de la línea LM3, derivada del adenocarcinoma mamario murino
M3, de aparición espontánea en hembras BALB/c en el bioterio del Instituto A.H.
Roffo (9). Se obtuvieron suspensiones de las células, que crecen en monocapa,
por tratamiento con una solución de tripsina 0,25% y EDTA 0,02% en PBS libre de
calcio y magnesio. Cada 2 días se reemplazó el medio de cultivo MEM con 5% de
suero fetal bovino (SFB). La viabilidad celular se evaluó por el test de
exclusión de azul Trypan y sólo se utilizaron suspensiones con una viabilidad
mayor que el 90 %.
Obtención de sueros e IgG de
portadores de tumor LM3
Hembras
BALB/c se inocularon en un flanco con 4x105 células LM3 y se obtuvieron portadores de tumor pequeño (Tp) (masa tumoral: 0,260±
Proliferación celular
Las
células LM3 se sembraron en placas de 96 pocillos (104 cél./pocillo)
en MEM con 5% de SFB, se incubaron por
24 horas a 37oC y se deprivaron de suero 24 horas antes del ensayo.
Luego de tratar con atropina (AT) 10-
Ensayos de desplazamiento de la unión de [3H]-QNB
Se realizaron ensayos de
desplazamiento de la unión del antagonista muscarínico tritiado [3H]-QNB
con distintas concentraciones de la IgG
purificada del suero de portadores de Tp, TG y como control se utilizó IgG normal. Las células se cultivaron en placas de 48 pocillos
a 25oC durante 90 minutos en medio MEM con agitación en ausencia o
en presencia de las fracciones IgG, AT o AF-DX116 (antagonista
muscarínico M2 selectivo), con [3H]-QNB 1 nM. Los resultados se
expresaron como % de [3H]-QNB unido con respecto a la unión del
radioligando a células sin tratamiento, que se consideró como el 100% de unión
(11).
Ensayos de inmunomarcación post
electrotransferencia (Immunoblotting)
Preparación de lisados celulares
Las
células LM3 (2x107) se cultivaron en placas de
Petri de 100 mm de diámetro y luego
de 2 lavados con PBS se lisaron en 1 ml de buffer Tris-HCl 10 mM, pH: 7,4; MgCl2 5 mM, NaCl
50 mM, EDTA 1 mM, EGTA 1 mM, Tritón X-100 1%, NaF 50 mM, e
inhibidores de proteasas, durante
1 hora a 0 oC. Luego de sonicar
30 segundos a 4 oC, se
centrifugaron durante 20 minutos a 10000 rpm. La concentración de proteínas en
los sobrenadantes se determinó por el método de Lowry (10) y los mismos se
conservaron a –80 oC hasta su utilización.
Preparación de homogenatos de
tumor y corazón
Los
tumores se extirparon quirúrgicamente y
se homogeneizaron en buffer: Tris 20mM, pH 7,4; EGTA
Los homogenatos de corazón se obtuvieron
en buffer RIPA modificado: NaCl 150 mM, Tris-HCl 50 mM pH: 7,4; EDTA 1
mM, PMSF 1 mM, Triton X-100 1%, deoxicolato de sodio 1%, SDS 0,1%; aprotinina y
leupeptina 5 ug/ml. Los homogenatos se centrifugaron a 10000 rpm durante 10 minutos a 4°C.
Los lisados celulares y homogenatos tratados o no
con AT 10-
Inmunofluorescencia indirecta
Se incubaron 5x105
células LM3 en PBS con 0,5% leche descremada en polvo y se centrifugaron 5 minutos a
2000 rpm. Se agregó al pellet suero o IgG de portadores de TG (1mg/ml o
0,7mg/ml respectivamente) y se incubaron por 1 hora a
Angiogénesis inducida por células tumorales
Las células LM3 (2x106) se
resuspendieron en 1 ml de MEM y se trataron durante 1 hora con IgG
purificada de suero normal o de portadores de Tp o TG en ausencia o en
presencia de AT (10-6M). Luego se lavaron con medio fresco y se inyectaron (2x105cél./0,1 ml) por vía intradérmica con azul
Trypan, para visualizar el sitio de inoculación, en ambos flancos de ratones
BALB/c normales. Los ratones receptores de las células se sacrificaron con éter
cinco días después de la inoculación y la respuesta vascular se evaluó en la
cara interior de la piel con lupa (aumento 6,4 X). El método utilizado para
cuantificar la respuesta angiogénica se basó en la determinación de la densidad
de vasos (d) expresada como número de vasos por mm2 de piel
de ratón, según el criterio de Auerbach modificado (12).
Resultados
Modulación
colinérgica de la proliferación de células LM3 por el suero y la IgG de portadores del tumor
LM3
Teniendo
en cuenta que las células LM3 sobreexpresan RCM, investigamos la capacidad de
estas proteínas de actuar como Ags desencadenando una respuesta inmune humoral
en portadores de tumor. Realizamos curvas concentración-respuesta con los
sueros (0,5-10 mg/ml) o las IgG (0,0025-0,025 mg-ml) agregados al cultivo
durante distintos períodos de tiempo.
Las concentraciones
efectivas máximas de
los sueros e IgG fueron 2 mg/ml y 0,025 mg/ml
respectivamente para un tiempo de tratamiento de 1 hora. Observamos que el
suero de los portadores de Tp estimula significativamente la proliferación de
células LM3 en un 163% con respecto al basal (células sin tratamiento). Este
efecto fue reducido por el pretratamiento de las células con AT 10-
El
tratamiento con suero o IgG proveniente de hembras BALB/c normales estimuló la
proliferación celular aproximadamente en un 41% y 25% respectivamente. La AT no
modificó significativamente ninguno de los dos efectos.
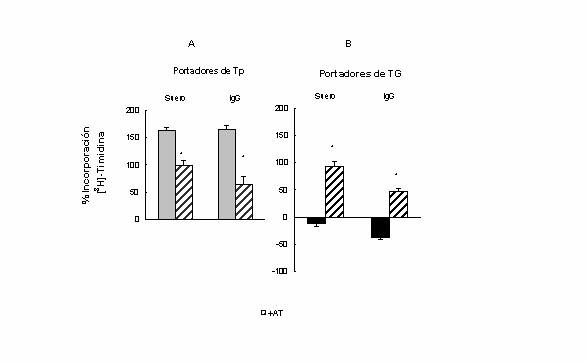
Figura 1 Efecto del tratamiento de células LM3 con suero e IgG
de portadores de (A) tumor pequeño (Tp) y (B) tumor grande (TG). Las células LM3 se trataron durante 1 hora
con los sueros (2 mg/ml) o IgG (0,025
mg/ml), luego el medio se reemplazó por medio fresco conteniendo timidina
tritiada ([3H]-Timidina) y se midió la proliferación después de 48
horas de cultivo como porcentaje de incorporación de [3H]-Timidina con respecto al
control (células sin tratamiento). Los valores son promedios ± E.S de 3
experimentos realizados por duplicado. *p<0.05
Desplazamiento de la unión del
antagonista muscarínico [3H]-QNB por la IgG
purificada del suero de portadores de tumor
Para confirmar la interacción de la
IgG purificada del suero de portadores de Tp y TG con los RCM expresados en
células LM3 realizamos
ensayos de desplazamiento de la unión de [3H]-QNB.
Como control positivo realizamos desplazamientos con concentraciones crecientes
de AT y AF-DX116, antagonista selectivo del receptor M2 que se expresa mayoritariamente
en las células LM3. En la Figura
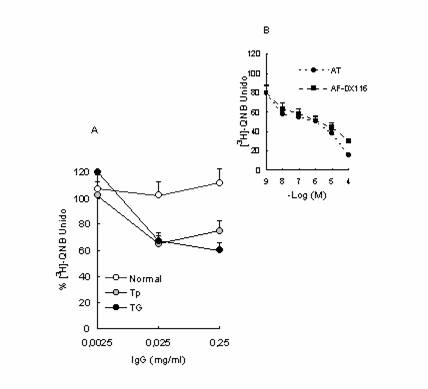
Figura 2. Ensayos de desplazamiento de la unión de [3H]-QNB.
Las células LM3 se incubaron con el radioligando en una concentración 1 nM en
ausencia o en presencia de concentraciones crecientes de: (A) IgG purificada del suero normal, o de portadores de tumor pequeño (Tp) o
grande (TG); (B) atropina (AT) y
AF-DX116. Los valores son promedios ± E.S. de
3 experimentos realizados por duplicado.
Inmunomarcación de los RCM por IgG de portadores de
tumor
Realizamos
ensayos de inmunomarcación (immunoblotting) utilizando como primer anticuerpo
los sueros o IgG obtenidos de portadores de Tp y TG sobre
homogenatos de tumor LM3 (Fig. 3A) y lisados de células LM3 (Fig. 3B)
previamente tratados o no con AT 10-
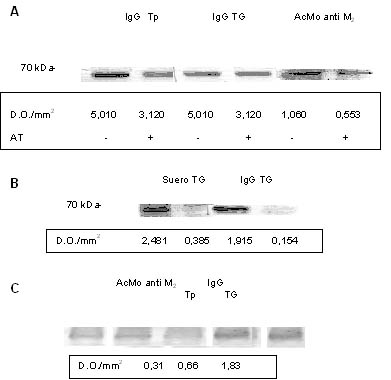
Figura 3. (A) Ensayo de Western blot sobre
tumor LM3. Los homogenatos de tumor tratados o no con
atropina (AT) 10-5 M, fueron inmunomarcados con IgG proveniente de sueros
de portadores de tumor pequeño (Tp) y tumor grande (TG) o con un anticuerpo
monoclonal anti M2. (B)
Ensayo de Western blot sobre lisados de células LM3 que fueron tratados o no
con atropina (AT) 10-5 M y fueron inmunomarcados con suero e IgG
proveniente portadores de tumor grande
(TG). (C) Ensayo de Western blot
sobre homogenatos de corazón murino. La IgG purificada de portadores de Tp y TG
inmunomarca una proteína de 70 kDa que
también es reconocida por un anticuerpo monoclonal contra el receptor M2. El peso molecular de las bandas se indica a
la izquierda. Las bandas se cuantificaron por densitometría y los resultados se
expresan en unidades de densitad óptica por milímetro cuadrado (D.O./mm2).
Se muestra un ensayo representativo de 3 realizados.
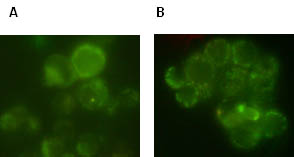
Figura 4. Inmunofluorescencia indirecta en células LM3 en
suspensión. (A) Suero de portadores
de tumor grande (TG) (1mg/ml) y (B)
IgG purificada del suero de portadores de TG (0,7 mg/ml). Se utilizó un segundo
anticuerpo anti IgG murina conjugado con FITC. Aumento 100X.
Modulación de la
angiogénesis tumoral por IgG de portadores de tumor LM3
Teniendo en cuenta que las fracciones IgG purificadas de los sueros de portadores de Tp
y TG tienen efectos opuestos sobre la proliferación de células LM3, estudiamos
la capacidad de dichos Acs para modular la angiogénesis, etapa fundamental en la progresión tumoral.
En la Figura
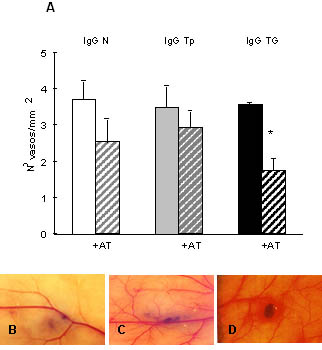
Figura 5. Ensayo de angiogénesis inducida por células
tumorales. (A) Las células LM3 (2x105)
se inocularon en forma subcutánea en hembras BALB/c, luego de ser tratadas con IgG
(0,025 mg/ml) purificada de animales normales (IgG N) o de portadores de tumor
pequeño (Tp) o tumor grande (TG) en ausencia o en presencia de atropina (AT)
(10-5M). Luego de 5 dìas se sacrificaron los animales y se
cuantificó la densidad de vasos en la cara interna de la piel en el sitio de
inoculación. *p< 0,05 (B) piel
normal (sin tratamiento) (C) piel
inoculada con células LM3 (D) piel
inoculada con células LM3 tratadas con IgG TG. Magnificación 6,4X.
Discusión
Se han realizado
varios intentos por demostrar la presencia de Acs específicos contra Ags
tumorales en pacientes con cáncer, pero los resultados son aún contradictorios.
Durante la década del ´80 se sugirió que
los linfocitos B de pacientes portadores de tumor no eran capaces de
desarrollar una respuesta inmune humoral anti-tumor. Más aún se afirmaba que
estas células no desempeñaban ningún rol en la progresión tumoral (3). Sin
embargo, recientemente se describió la presencia de Acs
en pacientes con distintos tipos de tumores que reconocen Ags tumorales y que pueden vincularse con
sindromes paraneoplásicos, lo que indica una respuesta policlonal,
multifuncional en estos pacientes (13-15).
Debe tenerse en cuenta que las proteínas sobre-expresadas en células
tumorales, podrían estar actuando como Ags desencadenando una respuesta inmune
humoral en portadores de tumor. Este podría ser el caso de los portadores del
tumor LM3, cuyas células derivan del adenocarcinoma mamario murino M3 y sobre-expresan receptores M2 en
comparación con las células de mama murina normal NMuMG (8). Nosotros
demostramos que tanto el suero, como la IgG de portadores murinos tempranos y
tardíos de tumor modulan la proliferación de células LM3 por vía muscarínica
pues el efecto se reduce significativamente por el pretratamiento con el
antagonista muscarínico AT. Previamente demostramos que la estimulación de RCM
con el agonista muscarínico carbacol (CARB), promueve la proliferación de
células LM3, con aumento de la actividad
de las enzimas fosofolipasa C y
óxido nítrico sintasa neuronal (11). En este sentido los autoAcs estarían
ejerciendo un efecto semejante al del agonista, promoviendo la proliferación y
favoreciendo el crecimiento tumoral. Wen
y col. investigaron el papel de Acs humanos en pacientes con cáncer de mama
e informaron la presencia de fragmentos Fab que reaccionan con Ags
expresados en tumores primarios de mama, estimulando la proliferación de
células tumorales de igual estirpe MDA-MB-231 y MCF-7, con participación de la vía ERK2
(16). También se ha descripto la presencia de Acs anti-RCM en pacientes con otras patologías crónicas
como miocardiopatías y exocrinopatías; estos Acs activan receptores M2
y M3, desencadenando señales de transducción que ejercen
efectos parasimpaticomiméticos, agravando
las condiciones de los pacientes (17,18).
Por el
contrario la IgG de portadores de TG inhibe la proliferación celular y el
bloqueo muscarínico revierte el efecto inhibitorio en estimulante. Estos
resultados indican la presencia de una fracción de Acs contra RCM con capacidad
inhibitoria y otra fracción capaz de estimular la proliferación por una vía no
colinérgica, cuyo efecto sea tal vez preponderante en portadores tardíos. Esta fracción estimulante estaría presente no
sólo en portadores de Tp sino también en el suero de animales normales, puesto
que tanto el suero como la IgG normal estimulan significativamente la
proliferación.
Además demostramos la interacción de los Acs provenientes de portadores
de Tp y TG con los RCM presentes en células LM3 pues estos desplazan
significativamente la unión del radioligando muscarínico [3H]-QNB. La IgG normal no fue capaz de desplazar la unión del radioligando
en ninguna de las concentraciones ensayadas lo que confirmaría que la estimulación
de la proliferación de células LM3 inducida por esta fracción es un efecto no
colinérgico.
Previamente demostramos que la población de receptores M2 es
mayoritaria en las células LM3 (11). Por
ensayos de Western blot observamos que tanto el suero como la IgG de portadores
de tumor reconocen estos receptores expresados sobre células tumorales y
corazón murino, pues las fracciones IgG
inmunodetectan una proteína cuyo peso molecular coincide con la que reconoce
un Ac monoclonal específico contra el receptor M2.
A pesar de que la IgG purificada de
portadores de TG inhibió la proliferación in
vitro de células LM3, se observa que el tumor continúa creciendo in vivo,
indicando que existen otros mecanismos que sostienen la progresión tumoral. Por
esto investigamos la participación de los Acs anti RCM en la angiogénesis
inducida por células tumorales.
Observamos que si bien el efecto estimulante de la IgG de portadores de
TG sobre la neovascularización no fue significativamente distinto del que producen
la IgG normal o de portadores de Tp, el
mismo fue inhibido por AT, indicando la participación de la vía muscarínica en
el proceso angiogénico. Previamente demostramos que el tratamiento de células
LM3 con CARB potencia la respuesta neovascular in vivo inducida por dichas
células, efecto que se revierte en presencia de AT o metoctramina, antagonista
M2 (19). Es posible que exista un mayor título de Acs anti RCM en
los portadores tardíos o que se modifique la especificidad por el subtipo M2,
aumentando la proporción de Acs contra este subtipo, involucrado principalmente
en la angiogénesis inducida por células LM3.
Estamos realizando nuevos experimentos para demostrar esta
hipótesis.
Concluimos que los portadores del
tumor LM3 poseen autoAcs contra RCM con distinta actividad biológica según el
estadío del tumor. Los portadores tempranos presentan en el suero autoAcs que
reconocen a los RCM y estimulan la proliferación celular; efecto
que disminuye significativamente por el tratamiento con AT. Esta reacción
autoinmune favorecería el crecimiento del tumor en esta etapa inicial. Los
portadores tardíos también presentan autoAcs que reconocen a los RCM. A pesar
de que esta fracción tiene actividad inhibitoria sobre la proliferación de
células LM3, promovería el crecimiento tumoral al estimular la angiogénesis.
Referencias
1.
Jakóbisiak M, Lasek W, Golab J. Natural mechanisms
protecting against cancer. Immunology Let 2003;
90: 103-122.
2.
Boon T, Cerottini JC, Van den Eynde B, van der Bruggen
P, Van Pel A. Tumor antigens recognized by T lymphocytes. Annu Rev Immunol
1994;12: 337-66.
3.
Manson
5.
Karim AR, Hughes RG, Winer JB, Williams AC, Bradwell
AR. Paraneoplastic neurological antibodies: a laboratory
experience. Ann N Y Acad Sci. 2005; 1050: 274-85.
6.
Gautier F, Irminger-Finger I, Gregoire
M, Meflah K, Harb J. Identification
of apoptotic product of BARD1 as an autoantigen: a potential factor in the
antitumoral response mediated by apoptotic bodies. Cancer Res 2000; 60:
6895-900.
7.
Hansen MH, Nielsen H, Ditzel HJ. The
tumor infiltrating B cell response in medullary breast cancer is oligoclonal
and directed against the autoantigen actin exposed on the surface of apoptotic
cancer cells. Proc Natl Acad Sci USA 2001; 98: 12569-664.
8.
Español A, Eiján AM, Mazzoni E, Davel L, Jasnis MA, Sacerdote
de Lustig E, Sales ME. Nitric oxide synthase, arginase and
cyclooxygenase are involved in muscarinic receptor activation in different
murine mammary adenocarcinoma cell lines. Int J Mol Med 2002; 9: 651-7.
9.
Urtreger
AJ, Ladeda VE, Puricelli LI, Rivelli A, Vidal MC, Lustig ES, Bal de Kier Joffé
E. Modulation of fibronectin expression and proteolytic activity associated
with the invasive and metastatic phenotype in two murine mammary tumor cell
lines. Int J Oncol. 1997; 11: 489-96.
10. Lowry
O, Rosenbrough N, Randall R, Farr A. Protein measurement with Folin phenol
reagents. J Biol Chem 1971; 193: 265-68.
11.
Español A, Sales ME. Different muscarinic receptors
are involved in the proliferation of murine mammary adenocarcinoma cell lines.
Int J Mol Med, 2004, 13:311-17.
12.
Davel L, Español AJ, de la Torre E, Jasnis MA, Ribeiro ML, Gotoh
T, Sacerdote de Lustig E, Sales ME. Different mechanisms lead to
angiogenic process in three tumor cell lines. Angiogenesis 2004; 7:45-51.
13.
Bazhin AV, Shifrina ON,
Savchenko MS, Tikhomirova NK, Goncharskaia,
MA, Gorbunova VA, Senin II, Chuchalin AG, Philippov PP. Low titre against recoverin in sera of patients with small cell lung
cancer without a loss of vission. Lung Cancer 2001; 34: 99-104.
14.
Antoine JC, Absi L, Honnorat J, Boulesteix, JM, de Brouker T, Vial C, Butler M, De Camilli P. Michel D. Antiamphiphysin antibodies are associated with
various paraneoplastic syndromes and tumors. Arch Neurol 1999; 56: 151-152.
15. Fernandez Madrid F, Karvonen RL, Ensley J, Kraut, M,
Granda JL, Alansari H, Tang N, Tomkiel JE. Spectra of antinuclear antibodies in
patients with squamous cell carcinoma of the lung and of the head and neck.
Cancer Detect Prev 2005;29: 59-65.
16.
Wen YJ, Mancino A,
Pashov A, Whitehead T, Stanley J, Kieber-Emmons T. Antigen binding of human IgG Fabs mediate ERK-associated proliferation
of human breast cancer cells. DNA Cell Biol. 2005; 24:73-84.
17.
Wang W, Guo G, Tang J, Li J, Zhao R, Hjalmarson A, Michael Fu L.X. Stimulatory
activity of anti-peptide antibodies against the second extracellular loop of
human M2 muscarinic receptors. Chin Med J (Engl). 2000; 113:867-71.
18.
Humphreys-Beher MG, Brayer J, Yamachika S, Peck, AB, Jonsson R. An alternative perspective to the immune response in autoimmune
exocrinopathy: induction of functional quiescence rather than destructive
autoaggression. Scand J Immunol. 1999;
49:7-10.
19.
Español AJ.
Davel L, Jasnis MA, Ribeiro ML, Sacerdote de Lustig E, Sales ME. La
proliferación, la angiogénesis y el crecimiento tumoral son modulados por el
sitema nervioso autónomo parasimpático. Medicina 2002; 65:512-513.
Agradecimientos
Este trabajo fue realizado con el apoyo de la
Universidad de Buenos Aires, subsidio UBACYT MO04, Programación Científica 2004-2007.
Correspondencia
a:
Prof. Dra. María Elena Sales
Centro de Estudios
Farmacológicos y Botánicos (CEFYBO)-CONICET
Paraguay 2155 Piso 16 Sector Derecho
Buenos Aires-Argentina
TE-FAX: 011-4508-3680
e-mail: mesales@2vias.com.ar
|
|
Revista QuímicaViva Número 3, año 4, diciembre 2005 quimicaviva@qb.fcen.uba.ar |