Luces y sombras de la vacuna
antipoliomielítica
Dra. Celia
E. Coto*
Laboratorio de Virología. Departamento de Química
Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos
Aires. Ciudad Universitaria. Pabellón 2. Piso 4. C1428EGA.Capital Federal. Argentina.
virocoto@qb.fcen.uba.ar
Recibido: 17/11/2005
Aceptado:
1/12/2005
Versión para imprimir

La vacuna antipoliomielítica salvó muchas vidas pero dejó entre nosotros el
virus SV40, agente de tumores en roedores, que de otra forma difícilmente
hubiéramos conocido.
Luces y sombras
En abril de 2005 se cumplió el
quincuagésimo aniversario del licenciamiento de
la primera vacuna contra el virus polio creada por Jonas Salk en la Universidad
de Pittsburgh, Estados Unidos (1). La vacuna antipoliomielítica inactivada
(VPI), conocida también con el nombre de vacuna Salk, consiste en una supensión
incolora estéril que contiene los tres serotipos del virus polio (I, II y III)
inactivados con folmaldehído. La vacuna se preparó originariamente en cultivos
primarios de riñón de mono Rhesus.
Los ensayos clínicos comenzaron en 1954, en plena epidemia de poliomielitis,
y los resultados entre los grupos de
voluntarios fueron tan efectivos, que el gobierno autorizó, en tiempo récord,
su aplicación masiva.
Para
tranquilidad de los lectores de este artículo, aclaremos que en 1987 se obtuvo
una versión más potente de esta vacuna, más antigénica, y preparada en cultivos
de células humanas. Se sabe que la forma potenciada de la vacuna induce altos
títulos de anticuerpos después de dos dosis y “seroconvierte” al 94-100% de los
vacunados, mientras que la aplicación de tres dosis “seroprotege” casi al 100%.
La inmunización impide que el virus pueda arribar, en caso de infección, al
sistema nervioso central y produzca parálisis. La inmunidad persiste por muchos
años y, aunque no hay una protección del tracto intestinal, no induce IgA. De
hecho, países como Suecia, Finlandia,
Holanda, Noruega, Islandia y Canadá están libres del virus polio sólo por la
vacunación con VPI.
En 1958, Albert Sabin desarrolló una vacuna
atenuada contra el virus polio, conocida como vacuna oral (VOP). Esta vacuna se obtuvo atenuando las
cepas salvajes del virus por medio de pasajes sucesivos de cada uno de los
serotipos en células epiteliales de riñón de mono. La forma oral comúnmente
usada de esta vacuna es trivalente, lo que significa que contiene los tres
serotipos virales. A diferencia de la IPV y, puesto que son virus atenuados,
multiplican en el intestino e inducen inmunidad en forma similar a la infección
natural, la diferencia radica en que la atenuación consiste en que los virus
que contiene no son neurovirulentos, lo que se demuestra por inyección
intraespinal en primates. La vacuna tiene la ventaja de su administración oral
y no subcutánea, como la IPV. Asimismo, produce protección del epitelio
gastrointestinal e inmunidad de por vida.
Por esa razón, y por resultar más económica, muchos países la adoptaron
en forma inmediata, sobre todo Rusia, país donde la vacunación fue masiva. La
persona vacunada excreta virus en las heces por varios días y, aunque hay
una probablidad cierta de que el virus
eliminado se vuelva virulento después de varias rondas de replicación
intestinal, no resulta peligroso para el entorno, siempre y cuando las personas
que están en contacto con un niño vacunado estén inmunizadas.
Debido a que la vacuna oral es una mezcla de virus atenuados, la
replicación exitosa de uno de los serotipos interfiere con los otros dos, de
modo tal que, para lograr inmunidad contra las tres clases de virus polio
patógeno, es necesario administrar tres dosis. Si bien esta situación trae
problemas en cuanto a la completud del esquema de vacunación, no es esa la
dificultad más grave asociada a la vacuna. Los CDC * (2) de los Estados Unidos
estiman que, a pesar de la atenuación del virus, por cada 2,5 millones de dosis
se produce un caso de poliomielitis paralítica asociado a la vacuna (PAV). El
riesgo aumenta para los niños cuando reciben la primera dosis, éste se estima
en 1 caso cada 790.000 dosis y para los niños que viven en países del tercer
mundo, debido a la desnutrición e inmunodeficiencia, el riesgo asciende a 1
caso entre 520.000 vacunados.
Con estas herramientas imperfectas y la férrea voluntad mancomunada
bajo la denominación: “Iniciativa para la erradicación global de la polio”,
patrocinada por la OMS (Organización Mundial de la Salud), UNICEF, el Rotary
Internacional y los CDC, llegamos a
noviembre de 2005 con datos optimistas. El informe provisto por los mencionados
organismos destaca una reducción del 99%
en el número de casos de poliomielitis entre 1988 y el 1º de noviembre de 2005.
Traducido en números: de 350.000 casos anuales en 1989 se ha pasado a un
presente de 1.469. Todavía hay seis países que se consideran endémicos para
polio en los que están presentes los serotipos I y III que son Nigeria, India,
Pakistán, Afganistán, Niger y Egipto. Pero el virus polio (el vacunante o el
salvaje) no se da por vencido y ha
reaparecido en países ya declarados libres de la enfermedad. Un total de once
países fueron reinfectados en el período 2004 a 2005, ellos son Somalia, Indonesia, Yemen, Angola, Etiopía, Chad, Sudán,
Malí, Eritrea, Camerún y Nepal (3). Que esto ocurra en los países mencionados
aflige pero no sorprende, lo que inquieta es la aparición de cuatro casos de
poliomielitis en niños de una comunidad Amish en Minnesota, EE.UU. La noticia
trascendió a la prensa el mes de octubre pasado. Las autoridades sanitarias
señalan que se trata de la introducción del virus entre los Amish por una
persona vacunada en otro país (4). Dado que la comunidad religiosa protestante
involucrada se niega a vacunarse, no se descarta la aparición de un brote.
Precisamente, el último brote de polio en los Estados Unidos ocurrió en 1979,
también en una comunidad Amish. Desde entonces los americanos se consideraron
libres del virus y, debido a los accidentes con la VOP, ocho casos paralíticos
al año, también dejaron de usar esta
vacuna y desde 2000 sólo utilizan la VIP para inmunizar.
Hasta aquí los
hechos. Las autoridades sanitarias deberían estar muy alertas ante este
episodio de reintroducción, que no parece ser un fenómeno único de los países
pobres.
Las dudas
que dejaron los primeros lotes de vacuna
Quizás el concepto generalizado,
predominante en la época en que se desarrolló la vacuna contra el virus polio,
de que los virus eran todos citolíticos, impidió sospechar la presencia de otro
agente viral en los cultivos de células de mono que fueron usados para obtener
la VIP y la VOP. Ni el uso del formaldehído, eficiente para inactivar al virus
polio en la VIP, logró eliminar por completo al virus contaminante SV40 por ser
más resistente que aquél, Por lo tanto, fue suministrado con su capacidad
intacta para replicar en muchos niños vacunados. ¡Qué decir de los primeros
lotes de la vacuna VOP que no sufrían proceso alguno de inactivación! Se
calcula que en el período que va de 1955 a 1963 las vacunas contra el virus
polio habían sido administradas a un estimado de 100 millones de personas.
Recién a partir de 1963 el virus SV40 fue eliminado de las vacunas, aunque para
el período mencionado fue dispersado también en la población por otras vacunas.
Así, desde
enero de 1959 hasta diciembre de 1961, todos los varones ingresantes al
ejército de los Estados Unidos, varios miles,
recibieron por vía parental una vacuna contra Adenovirus 3 y 7 preparada
en células de mono que contenían SV40. Lo más notable de este caso es que,
según se supo más tarde, el adenovirus no puede replicar en esas células si no
está presente el SV40, de modo que la infección mixta dio lugar también a ADN
virales híbridos (5).
Luces y sombras
El virus
SV40 es un virus icosaédrico de tamaño pequeño, alrededor de 55 nm, cuyo ADN es
doble y circular, y pertenece al género papilomavirus de la familia Papovaviridae. Su nombre en inglés
(simian virus 40) es un acrónimo formado por S (por su procedencia de los
simios), V (porque forma vacuolas en el citoplasma celular) y 40 (fue el
aislamiento número 40) a partir de cultivos primarios de riñón de mono. Su
presencia se manifestó por la vacuolización extensa del citoplasma de las
células (6).
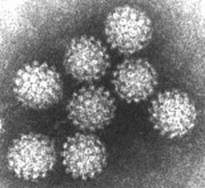
Microscopía electrónica de partículas de virus SV40
visualizadas por tinción negativa.
En forma
inmediata a su descubrimiento, el virus SV40 demostró su potencial oncogénico
para producir tumores en ratones y hámsters y transformar muchos tipos de
células en cultivo, incluso las de origen humano. El virus se pudo aislar
también de algunos lotes de vacuna, razón por la cual, se instaló en el mundo
científico el angustioso interrogante sin respuesta definitiva aún ¿el virus
SV40 podrá producir cáncer en el hombre?
Desde su
aislamiento en 1960 el virus SV40 se convirtió en uno de los virus más
estudiados, y se constituyó en una herramienta de vital importancia en el
desarrollo de la biología molecular. Una de las proteínas no estructurales del
SV40 es la conocida también como
antígeno T u oncoproteína, que es esencial para la replicación del virus y que
afecta al ciclo de la célula donde éste se aloja. Entre todos los adelantos
científicos promovidos por el estudio con SV40 se destacan: 1) fue el primer ADN
eucariótico completamente secuenciado, 2) permitió el reconocimiento de
sectores del ADN que actúan en calidad de enhancers
o estimuladores de la síntesis de ADN, 3) permitió identificar algunos pasos de
la replicación del ADN eucariótico y explicar el fenómeno de splicing alternativo, 4) saber de la
necesidad de una transcripción contínua de una proteína viral no estructural
para el mantenimiento de la transformación, 5) la identificación de proteínas
supresoras de tumores como la p53 y RB 6) conocer el efecto de los virus ADN
sobre la regulación del ciclo celular, 7) identificar la presencia de señales
en las moléculas de proteínas que determinan su localización nuclear (7).
El virus SV40 tiene como huésped a varias especies de
monos en las que no causa daño aparente a menos que esté acompañado por el
virus SIV (virus de la inmunodeficiencia del simio). En realidad los
investigadores se preguntan de dónde proviene la infección del hombre con este
virus, ya que se lo ha detectado, en muchos casos, en personas que no habían
recibido la vacuna contaminada. Hay otros dos papiloma virus parecidos al SV40
que son de origen humano y que se conocen con el nombre de BK y JC
respec-tivamente. Dado que el ADN del virus BK tiene un 70% de homología con el
virus SV40, comparten antígenos. Casi todas las personas portan anticuerpos
contra el virus BK, cuya capacidad para enfermar se desconoce. Los estudios que
involucran anticuerpos pueden complicarse porque se ha comprobado que entre los
tres virus hay reacciones de inmunidad cruzada (8).
Sombras: los tres períodos
Durante un período aproximadamente de 40 años después de la
administración de las vacunas contaminadas, la búsqueda de evidencias
epidemiológicas para probar una mayor incidencia de cáncer entre los grupos de
vacunados que recibieron SV40 fue infructuosa. Estos estudios se realizaron en
diferentes países del mundo y fueron muy numerosos, no obstante, no se pudo comprobar que la aparición de
cáncer fuera debida al virus, ni aún en aquellas personas que poseían
anticuerpos neutralizantes contra el mismo. Se podría afirmar sin ambages que
las autoridades sanitarias respiraron con alivio (9). Pero, la implementación de técnicas sensibles
como la PCR (reacción en cadena de la polimerasa) para la detección de secuencias
genómicas virales en tejidos provenientes de tumores, en la década del 90, puso de vuelta en la vidriera las inquietudes
respecto de la relación del virus SV40 y el cáncer. Entramos así en un segundo
período alarmante de por sí, que se extendió prácticamente hasta el año
2001-2003. Secuencias del ADN del virus SV40 o huellas de la presencia del
antígeno T aparecieron en distintos tipo de cánceres tales como mesoteliomas
pulmonares, epindemomas de cerebro o del plexo coroideo, osteosarcomas y por último
en linfomas no-Hodgkin (10, 11, 12, 13, 14, 15, 16). La bibliografía al
respecto es muy abundante y no podemos consignarla aquí en su totalidad.
A pesar de
las abrumadoras evidencias, y debido a
que algunos laboratorios no pudieron encontrar rastros del virus en tumores
similares, en 1997, se creó un “Grupo internacional de trabajo para el estudio
del virus SV40” para evaluar la relación entre este virus y el cáncer. Sus conclusiones sin definición a favor o en contra
se pueden conocer en la referencia 17.
Fue hacia 1862 cuando Robert Koch, el
descubridor del bacilo de la tuberculosis, dio a conocer una serie de
condiciones que se deben aplicar a un microorganismo para poder concluir que es
el agente causal de una determinada enfermedad. Estas condiciones que pasaron a
la historia con el nombre de postulados
de Koch establecían que el microrganismo aislado de un tejido o fluidos de
un enfermo con cierta patología debería reproducir en un modelo animal la misma
patología, lo que implica el aislamiento del microorganismo vivo, su cultivo y
posterior inoculación. Estos postulados encorsetaron la microbiología por más
de un siglo hasta que las técnicas moleculares para detección de ácidos
nucleicos, entre otras, han ido minando la inmovilidad de estos férreos
principios y ya para la década del 90 aparecieron trabajos que discuten la
reconsideración de los postulados de Koch.
Este sería el caso del virus SV40, ya que,
como tal, no ha podido ser aislado de humanos, aunque su presencia se infiere
por las secuencias virales detectadas en los tumores, y, además, como dijimos
más arriba, por la presencia de anticuerpos circulantes.
Hay en esta historia un tercer período
que se extiende hasta el presente en que se ha tratado de descalificar los
resultados obtenidos con el uso de la tecnología molecular. En este compromiso se encuentra la “División de cáncer, epidemiología y
genética” (DCEG) del Instituto Nacional de Cáncer de los Estados Unidos (18),
mientras que otras instituciones, como el NIH de EE.UU., están subsidiando
numerosos proyectos para resolver el problema planteado hace cincuenta años
atrás (19).
Por ahora, nos quedamos sin saber
cuánto tiempo transcurrirá hasta que sea posible responder algunas preguntas :¿el virus SV40 causa
cáncer o es un cofactor coadyuvante? ¿la alta sensibilidad de las técnicas
moleculares puede inducirnos a errores de tanta gravedad?
Entretanto, vale la reflexión sobre los
problemas interminables que puede acarrear el uso de cultivos celulares sin los
debidos controles en la producción de fármacos, si se volviera a cometer un
error de esta naturaleza en este siglo XXI, sería un accionar absolutamente
imperdonable, casi de naturaleza criminal.
Bibliografía
1.
MMWR.
april 8, 2005. 54(13), 335-336.
2.
*Centers for Diseases Control (EE.UU.)
3.
www.polioeradication.org
4.
http://www.usatoday.com/news/health/2005-10-13-minn-polio_x.htm
5.
Lewis AM Jr.
Experience with SV40 and adenovirus-SV40 hybrids. Biohazards in biological
research. New York (NY):
Cold
Spring
Harbor Laboratory Press;
1973. p96-113.
6.
Sweet BH, Hilleman,
MR. The vacuolating virus, SV40. Proc. Soc. Exp. Biol.Med. 1960; 105: 420—7.
7.
Butel JS, Lednicky JA. Cellular and Molecular Biology
of Simian Virus 40: Implications for human infections and disease. Journal of the National Cancer Institute
1999. 91: 119- 134.
8. Viscidi RP, Rollison DEM, Viscidi E, Clayman B, Rubalcaba E,
Richard D, Mayor EO and Shah KV. Serological Cross-reactivity between Antibodies to
Simian Virus 40, BK virus, and JC Virus Assesed by Virus-like Particle-Based
Enzyme Immunoassays. Clinical and Diagnostic Immunonology 2003, 10: 278-285.
9.
http://www.cdc.gov/nip/vacsafe/concerns/Cancer/default.htm.
10. Pepper C, Jasani
B, Navabi H, Wynford-Thomas D, Gibbs AR. Simian virus 40 large T antigen
(SV40LTAg) primer specific DNA amplification in human pleural mesothelioma
tissue. Thorax 1996, 51:1074-1076.
11. Testa JR,
Carbone M, Hirvonen A, Khalili K, Krynska B, Linnainmaa K, et al. A
multi-institutional study confirms the presence and expression of simian virus
40 in human malignant mesothelioma. Cancer Res 1998, 58:4505-4509.
12. Griffiths DG, Nicholson AG, Weiss RA.
Detection of SV40 sequences in human mesothelioma. Dev Biol Stand 1998,
94:127-136.
13. Galateau-Salle F, Bidet P, Iwatsubo Y,
Gennetay E, Renier A, Letourneux M, et al. SV40-like DNA sequences in pleural
meothelioma, bronchopulmonary carcinoma, and non-malignant pulmonary diseases.
J Pathol 1998,184:252-257.
14. Vilchez RA,
Madden CR, Kozinetz CA, Halvorson SJ, White, ZS, Jorgensen JL, et al.
Association between simian virus 40 and non-Hodgkin lymphoma. Lancet 2002,
359:817-823.
15. Shivapurkar NS, Harada K, Reddy J,
Scheuermann RH, Xu Y, McKenna RW, et al. Presence of simian virus 40 DNA
sequences in human lymphomas. Lancet 2002,359:851-852.
16. Lednicky JA, Garcea RL, Bersagel DJ, Butel
JS. Natural
simian virus 40 strains are present in human choroid plexus and ependymoma
tumors. Virology 1995,212:710-717.
17. The International SV40 Working Group. A multicenter evaluation of assays for detection of SV40 DNA and results in
masked mesothelioma specimens. Cancer
Epidemiol Biomarkers Prev 2001,10 (5):523-532.
18. http://researchportfolio.cancer.gov/.
19. http://www-commons.cit.nih.gov/crisp.
* Profesora titular
consulta de Virología. Facultad de Ciencias Exactas y Naturales. UBA.

