ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.ar
¿Estamos a las puertas de una nueva pandemia de influenza?
Vilma Savy*
Departamento Virología. Instituto Nacional de Enfermedades Infecciosas. ANLIS Carlos G. Malbrán
Recibido 13 de marzo de 2004/ Aceptado 19 de abril de 2004
Brotes y pandemias de influenza
Los virus de influenza A o B circulan virtualmente todos los inviernos en las zonas templadas del hemisferio norte y sur produciendo brotes estacionales de la entidad clínica conocida como gripe. En las regiones tropicales y sub-tropicales, la enfermedad ocurre generalmente durante todo el año aunque también pueden observarse picos estacionales. Los mismos se caracterizan por un aumento abrupto del número de consultas por enfermedad tipo influenza (ETI) asociado generalmente a un exceso de mortalidad por neumonías (1), con una duración aproximada de 4-8 semanas. La circulación viral se confirma con el aislamiento del virus en el laboratorio y su estudio antigénico y genético revela en la mayoría de los casos, una variación en la secuencia aminoacídica de los antígenos de superficie, hemaglutinina (HA) y neuraminidasa (NA), que es <1% respecto de la cepa viral que circulara con anterioridad dentro del mismo subtipo viral. Estas variaciones se producen debido a mutaciones puntuales que ocurren en ambas glicoproteinas de superficie y confieren al virus la capacidad de evolucionar en cortos períodos de tiempo. Nuevas cepas pueden emerger año a año como consecuencia de estos cambios, denominados deriva o “drift” antigénico.
Por otra parte, el genoma del virus influenza constituido por 8 segmentos de ARN, posibilita la formación de nuevos virus mediante la reasociación o intercambio de segmentos genéticos cuando se producen infecciones mixtas por virus con diferentes subtipos de HA en un único huésped susceptible. Mediante este mecanismo, denominado cambio o “drift”, surgen virus con HA y/o NA diferentes a los que estaban circulando en la población humana con anterioridad y, siendo ésta susceptible, se expanden mundialmente pudiendo producir una pandemia. Además, es necesario que el nuevo virus emergente tenga capacidad de infectar al hombre causando enfermedad clínicamente aparente y transmitirse fácilmente de persona a persona. Las pandemias de influenza han sido suficientemente documentadas por lo menos en los 3 últimos siglos, pero probablemente los datos más antiguos se remonten al siglo 12 y la primera de ellas claramente reconocida ocurrió en 1580 (2).
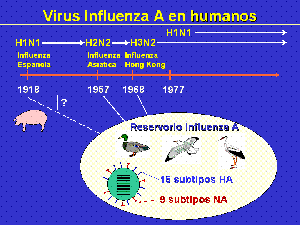
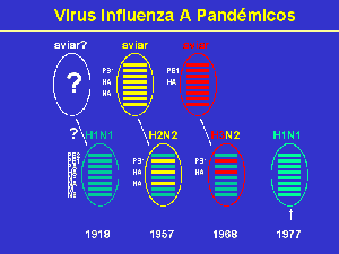
La pandemia de influenza de 1918-19 causada por un virus A(H1N1) (gripe española) relacionado a influenza porcina y de probable origen aviar causó entre 20 y 50 millones de muertes en todo el mundo. Este virus continuó causando brotes estacionales hasta 1957 cuando emergió un influenza A(H2N2) (gripe asiática) cuya mortalidad a nivel mundial se estimó en alrededor de 1 millón de personas. En 1968, este virus fue reemplazado por un influenza A(H3N2) o gripe de Hong Kong y finalmente, en 1977, se produce la re-emergencia de los virus A(H1N1) luego de una ausencia de circulación en la población humana de 20 años, con un menor impacto en la población ya que las personas mayores de 20 años tenían inmunidad residual por exposición previa a este antígeno . A diferencia de las situaciones previas de surgimiento de nuevos virus que reemplazaban totalmente a los anteriores, a partir de 1977 se produce la co-circulación de los virus A subtipo H1N1 con H3N2 conjuntamente con las cepas de tipo B.
Se considera que la transmisión interespecies ha tenido un rol fundamental en el origen de las pandemias de los últimos siglos. Hay evidencias de que los virus que ocasionaron las pandemias de 1957, A(H2N2), de 1968, A(H3N2) y la reemergencia de A(H1N1) en 1977 se originaron en China (Fig. 1). Se piensa que esta región provee un nicho ecológico adecuado para el surgimiento de virus influenza nuevos debido a la alta densidad de población humana en estrecho contacto con poblaciones de cerdos y de aves domésticas y de vida libre facilitando la reasociación genética (Fig. 2).
Un virus no erradicable
Se han descripto hasta el momento 15 subtipos de HA (H1 a H15) y 9 subtipos de NA (N1 a N9) de los virus influenza tipo A. Todos ellos han sido aislados de las aves acuáticas de vida silvestre, predominantemente patos, gansos y gaviotas que constituyen el reservorio natural del virus. En estos animales, los virus infectan las células del tracto intestinal y se excretan grandes cantidades por heces. La transmisión se realiza por la vía fecal-oral y el pico de mayor excreción ocurre cuando dejan el lugar de nidada y comienzan la migración anual. (3) De esta manera se infectan las aguas de lagos y reservas naturales. A partir del reservorio ocurren infecciones en otros huéspedes como las aves de corral, los cerdos, los caballos, los mamíferos marinos y el hombre. Si bien los virus de influenza aviar son generalmente no patógenos en sus huéspedes naturales, pueden causar significativa morbilidad y mortalidad luego de transmisión a otras especies. Desde el punto de vista epidemiológico, las especies más importantes son, además del hombre, las aves, los cerdos y los equinos. Los cerdos son susceptibles a la infección con virus influenza A provenientes de aves y de humanos, existiendo también transmisión ocasional del cerdo al humano aunque raramente se propaga luego de humano a humano. La presencia en el epitelio respiratorio del cerdo de ambos tipos de receptores descriptos para el virus a nivel de la membrana celular (a2-3 ácido siálico y a2-6 ácido siálico) explicaría esta posibilidad de infección con virus de distintos orígenes.
En las aves domésticas, la infección con influenza A produce una variedad de síntomas que van desde infecciones no complicadas hasta las más virulentas conocidas antiguamente como plaga aviar o actualmente como influenza aviar de alta patogenicidad (AP) que pueden producir mortalidad de hasta el 100%. Los virus que producen estas últimas se ubican en los subtipos H5 y H7. Estas infecciones se autolimitan o se controlan por el sacrificio de las aves con las consiguientes pérdidas económicas y su impacto en la economía de la región. Las aves silvestres pueden jugar un rol en la introducción de un virus de baja patogenicidad en aves domésticas donde, si circula libremente, puede mutar a una forma de AP. Hasta el momento no ha sido demostrado que las aves silvestres sean la fuente de los actuales brotes por H5N1 AP. Entre 1959 y 2003, sólo 21 brotes de influenza aviar AP producidos por distintos subtipos de virus fueron informados a nivel mundial, la mayoría en Europa y América. (4) En los últimos años, la cantidad y frecuencia de episodios de influenza aviar en aves domésticas fueron en aumento, lo que indicaría una adaptación continua del virus desde los reservorios de aves acuáticas. Desde mediados de diciembre de 2003, ocho países asiáticos confirmaron brotes de influenza aviar AP causados por cepas H5N1, la mayoría de ellos por primera vez. La extensión de los brotes dentro de un país y a otros países, tuvo como consecuencia la muerte por enfermedad o por sacrificio de más de 100 millones de aves. Esta nueva situación demostró que existe falta de experiencia en la mayoría de estos países en el control y prevención de la enfermedad así como falta de infraestructura y recursos adecuados para realizar las acciones recomendadas por los organismos internacionales para evitar la propagación y/o reintroducción del virus. El desafío mayor para el control de influenza radica en la extensa magnitud de los reservorios animales, sus características migratorias y la capacidad de infectar distintos huéspedes así como la extensión de los criaderos de aves de corral en establecimientos no controlados como las pequeñas granjas de áreas rurales de China y varios de los países implicados en el brote actual.
En cuanto a la situación en nuestro país, no se han detectado en Argentina infecciones de aves domésticas por estos virus, por lo que se considera al país libre de influenza aviar. (5) Por otra parte, en la región sólo fue detectado en Chile un brote de influenza aviar por virus H7N3 en 2002, el cual fue rápidamente controlado.
El salto de especie. Últimos episodios.
Durante muchos años se pensó que para lograr una eficiente introducción en humanos de un nuevo virus de influenza era necesario que los cerdos actuaran como huésped intermediario o “balón de mezclado”debido a poseer éstos los receptores específicos de virus humanos y aviares. Los virus del subtipo H5 amenazan surgir como un patógeno humano pandémico desde 1997, ocasión en la que fallecieron 6 de 18 personas infectadas con un virus de origen aviar AP durante una epizootia que causaba 100% de mortalidad entre las aves domésticas, patos y gansos. (6) El virus A/Hong Kong/97 se originó por reasociación del gen de la HA de un virus de ganso H5N1, del gen de la NA de un virus H6N1 de un ave silvestre de la región (teal) y de los genes internos de un virus de codorniz H9N2 y nuevamente el H6N1 de teal. Posteriormente, la alta patogenicidad de este nuevo virus fue asociada con la presencia de una serie de aminoácidos básicos adyacentes al sitio de clivaje de la HA, siendo el clivaje imprescindible para la infectividad viral.
Desde ese episodio ocurrido en Hong Kong en 1997, se describieron una serie de eventos donde se demostró la infección directa de humanos con virus de origen aviar H9N2, H7N7 y H5N1 aunque todos ellos carecieron de la capacidad de transmitirse eficientemente en la población humana. Los episodios más importantes ocurrieron en marzo de 2003 en Holanda y, a principios de 2004, en países del sudeste asiático fundamentalmente Camboya y Tailandia. En el primer caso, el 1° de marzo de 2003, se aislaron en Holanda cepas A(H7N3) y A(H10N7) de criaderos de patos. Una semana más tarde, se produce el primer caso de conjuntivitis en humano por un virus A(H7N7) y a fines del mismo mes se detectan virus de influenza aviar AP (H7N7) en patos y cisnes; por último, en abril, se los detecta en cerdos. Durante el mes de abril se producen 84 casos de conjuntivitis y sindrome gripal entre trabajadores de granjas en contacto con las aves infectadas. A todos se les administró antivirales específicos (oseltamivir) y la vacuna de influenza correspondiente a la temporada para disminuir la probabilidad de que se produzca reasociación de virus humano y aviar lo cual podría conferir al virus la capacidad de propagarse persona a persona. Hubo un caso fatal y sólo se detectó transmisión persona a persona desde un trabajador infectado hacia su familia.
El segundo caso ocurre a principios de diciembre de 2003, cuando ocho países de Asia (Camboya, China, Indonesia, Japón, Laos, Corea, Tailandia y Vietnam) comienzan a informar la existencia de brotes de influenza aviar H5N1 en diferentes especies de aves(7). Dos de ellos, Tailandia y Vietnam, también denunciaron la ocurrencia de 34 casos confirmados en humanos , 23 de los cuales fallecieron. Es probable que el número de casos humanos sea mucho mayor pero no se dispone aún de la confirmación por laboratorio del agente causal de los mismos. Los casos ocurrieron entre trabajadores de granjas que tuvieron manipulación directa de pollos o patos enfermos o muertos y en estudiantes que tuvieron contacto con gallos de riña o con patos adquiridos como mascota o que habitaban zonas rurales con brote de influenza aviar.
Preparación para la pandemia.
Luego de la exposición de los sucesos que se vienen sucediendo a nivel mundial, es razonable asumir que ocurrirá una nueva pandemia de influenza aunque no podemos prever cuando ocurrirá ni cual será el virus que la ocasione. El estado actual del conocimiento de la biología, la ecología y la epidemiología de influenza nos permiten evaluar que existen condiciones para la emergencia de un nuevo virus de influenza fundamentalmente en comunidades rurales con alta densidad de población.
La Organización Mundial de la Salud lidera el programa mundial de vigilancia y control de influenza cuyos objetivos principales son reforzar la vigilancia, aumentar el conocimiento del impacto de la enfermedad, extender el uso de vacunas y acelerar la preparación de los planes nacionales para enfrentar la pandemia. La experiencia adquirida a nivel de cooperación internacional luego de los hechos de 1997 en Hong Kong, fue determinante en la adquisición del equipamiento tecnológico y la disponibilidad de reactivos para detectar nuevos virus de influenza. Debido al carácter global de las pandemias de influenza, esta cooperación será ...Se requerirá el esfuerzo
Los niveles de preparación definidos por la OMS (Tabla 1) nos ubican en la actualidad en la fase 0, nivel 2 de una posible pandemia. (8) La vigilancia mundialde influenza puede proveer una alarma temprana que puede salvar miles de vidas. Los elementos de intervención con que contamos, vacunas y antivirales, es muy probable que no estén disponibles en cantidades suficientes cuando se produzca la primera ola de expansión del nuevo virus. Por ello, es importante definir previamente a qué grupos de riesgo serán destinados los medicamentos disponibles para disminuir en lo posible la morbi-mortalidad y los efectos de disrupción social que se esperan.
Respecto de las vacunas, en la actualidad sólo las vacunas inactivadas ofrecen un medio inmediato de respuesta para una profilaxis masiva (9), aunque los sustratos utilizados (huevos embrionados) limitan la capacidad de producción. En algunos países, ya están aprobadas las vacunas preparadas en cultivos celulares o a virus atenuados que podrían suplementar su disponibilidad. Actualmente se utiliza la capacidad de reasociación del virus influenza para producir virus recombinantes con los genes de HA y NA de las características deseadas (producen respuesta de anticuerpos neutralizantes) y genes provenientes de virus de alto crecimiento en embriones de pollo y seguros para el humano. Mediante este procedimiento, se tarda no menos de 6 meses en disponer de un stock de vacuna probada. En el caso de la preparación de vacunas para los subtipos H5 y H7, estas cepas que conservan su composición de múltiples aminoácidos básicos en el sitio de clivaje de la HA son AP para los embriones y no se puede obtener una buena progenie viral por su rápida letalidad. Por lo tanto, se está recurriendo a la genética reversa mediante la cual se pueden obtener en forma individual los genes deseados por clonación de cada uno de los genes del virus y también eliminar las secuencias de aminoácidos básicos del gen de la HA. El virus semilla obtenido será transfectado en una línea celular adecuada ( p.ej.Vero) para producir partículas virales viables. Estas nuevas vacunas requieren de ensayos clínicos controlados, luego de los cuales deberán ser aprobadas por las autoridades regulatorias las que, en muchos países, no aprueban el uso de microorganismos modificados genéticamente en seres humanos.
Podemos asegurar que, a nivel mundial, no estamos preparados para responder si una pandemia se declarara en el corto plazo. En nuestro país, libre de influenza aviar y no productor de vacunas, los esfuerzos tienden a mejorar la capacidad de detección por el laboratorio de nuevas cepas de virus y disponer de una vigilancia epidemiológica capaz de detectar tempranamente eventos no usuales en salud humana y animal.
Tabla 1. Fases de respuesta de la OMS
|
Fase 0 |
Actividades interpandémicas |
|
Fase 0, nivel 1 |
Nueva cepa en un caso humano |
|
Fase 0, nivel 2 |
Infección humana confirmada |
|
Fase 0, nivel 3 |
Transmisión humana confirmada |
|
Fase 1 |
Comienzo de la pandemia confirmado |
|
Fase 2 |
Epidemias regionales y multiregionales |
|
Fase 3 |
Fin de la primer onda pandémica |
|
Fase 4 |
Onda pandémica secundaria o tardía |
|
Fase 5 |
Fin de la pandemia (vuelve a fase 0) |
Bibliografía.
1- Nicholson KG. Impact of influenza and respiratory syncytial virus on mortality in England and Wales from January 1975 to December 1990. Epidemiol Infect 1996; 11: 651-63.
2- Nguyen-Van-Tam JS and Hampson AW. The epidemiology and clinical impact of pandemic influenza. Vaccine 2003; 21: 1762-68.
3- Fouchier RAM, Osterhaus ADME, Brown IH. Animal influenza virus surveillance. Vaccine 2003; 21: 1754-57.
4- OMS http://www.who.int/csr/don/2004_03_02/en/ . Avian influenza A(H5N1)-update 31- Situation poultry in Asia: need for a long-term response, comparison with previous outbreaks.
5- SENASA http://www.elsitioagricola.com/gacetillas/senasa/20040128influenza.asp. Argentina país libre de influenza aviar.
6- Nicholson KG, Wood JM, Zambon M. Influenza. Lancet 2003; 362: 1733-45.
7- OMS http://www.who.int/csr/disease/avian_influenza/en/ . Avian influenza A(H5N1): Update 33.
8- Cox NJ, Tamblyn SE, Tam T. Influenza pandemic planning. Vaccine 2003; 21: 1801-03.
9- Webby RJ, Webster RG. Are we ready for pandemic influenza? Science 2003; 302: 1519-22.
* La Dra. Vilma Savy es Viróloga, Responsable del Centro Nacional de Influenza (OMS).
Departamento Virología. Instituto Nacional de Enfermedades Infecciosas. ANLIS Carlos G. Malbrán
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.ar